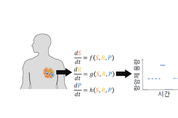
[더테크=전수연 기자] 한국과학기술연구원(KIST) 천연물인포매틱스연구센터 김은정 박사팀이 항암제 내성과 가소성이 있는 암 조직의 치료에 효과 있는 최적의 용량 제안 수리 모델을 개발했다고 18일 밝혔다. KIST는 암에 항암제 내성이 생기거나 재발하는 경우가 많아 지속 관리가 필요한 난치병이라고 판단했다. 현재 표준 암 치료법은 환자에게 심각한 부작용이 나타나지 않는 최대용량의 항암제를 주입하는데 항암제에 저항성이 있는 세포의 성장을 촉진하거나 정상 세포를 손상하는 등 의도하지 않은 결과가 나타나기도 한다. 항암제 저항성을 최소화하기 위해서는 최적의 용량과 투약 기간을 찾는 연구가 필요하다. 지금까지는 소수의 암 환자를 대상으로 하는 제1상 임상시험 결과로 결정된 최대 내약 용량(maximum tolerated dose)을 중심으로 항암치료가 진행되고 있다. 현재까지 개발된 수학 모델은 암 치료 중 생긴 항암제 내성과 암세포의 빠른 진화 변화가 치료 결과에 미치는 영향까지는 고려하지 못했다. 연구팀이 제안한 계산법은 항암제 치료 중 생길 수 있는 내성, 암세포의 일시 표현형 변화를 고려해 필요한 적정용량을 제안해주는 최초의 항암제 용량 예측 모델이다. 연구
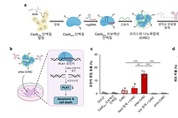
[더테크=조재호 기자] 카이스트가 유전자 가위 기술 기반의 항암 신약 기술을 개발했다. 이번 연구를 기반으로 유전자 교정 치료 및 다양한 암종에 적용할 수 있는 플랫폼 기술로 기대된다. 카이스트는 8일 정현정 생명과학과 교수 연구팀이 항암 신약을 개발해 암세포 선택적 유전자 교정 및 항암 효능을 보였다고 밝혔다. 이번 신약은 크리스퍼(유전자 가위) 기반 표적 치료제로 항체를 이용한 크리스퍼 단백질을 생체 내 표적 조직에 특이적으로 전달하는 방법이다. 유전자 치료에 사용하는 바이러스 기반 전달 방법은 인체 내 면역 부작용이나 발암성 등 한계점을 지녔다. 이에 비 바이러스성 전달 방법으로 단백질 기반의 크리스퍼 기술이 전달은 높은 안정성을 지녀 치료제로서 개발이 적합한 방법으로 알려졌다. 하지만 크리스퍼 단백질은 분자량이 커 전달체의 탑재가 어렵고 전달체의 세포 독성 문제 및 낮은 표적 세포로의 전달에 있어 어려움이 있었다. 이러한 문제점을 극복하기 위해 연구팀은 크리스퍼 단백질에 특정 아미노산을 변경해 다양한 생체분자를 보다 많이 결합하고 생체 내 본질적인 생화학 과정을 방해하지 않는 단백질을 개발했다. 그 결과 기존 비 바이러스성 전달체의 문제 해결 및 표적






